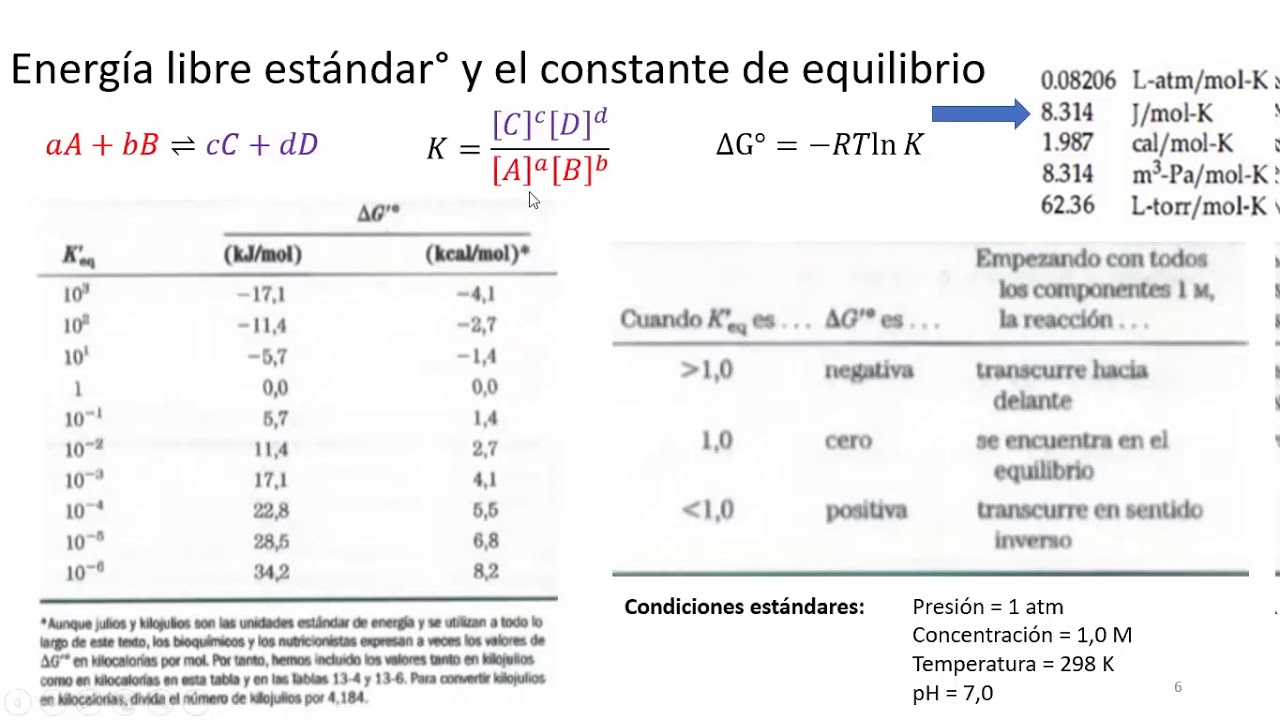
La energía libre estándar de formación (ΔG o f), es el cambio en la energía libre que se produce cuando se forma 1 mol de una sustancia en su estado estándar a partir de los elementos componentes en sus estados estándar. Los valores tabulados de las energías libres estándar de formación se utilizan para calcular ΔG° para una reacción.. Esta ecuación describe cómo varía el potencial de un sistema redox (como una celda galvánica) con respecto a su valor de estado estándar, concretamente, mostrando que es una función del número de electrones transferidos, n, de la temperatura, T, y de la composición de la mezcla de reacción reflejada en Q.Una forma conveniente de la ecuación de Nernst para la mayoría de los trabajos.
Energía libre de Gibbs y entropía Calcular entropía y entalpía Vídeo Dailymotion
13 3 Energía libre de Gibbs y el constante de equilibrio YouTube

Energía libre de Gibbs

Energía libre de Gibbs Espontaneidad Introducción YouTube

024.Problemas Termoquímica. Energía Libre YouTube

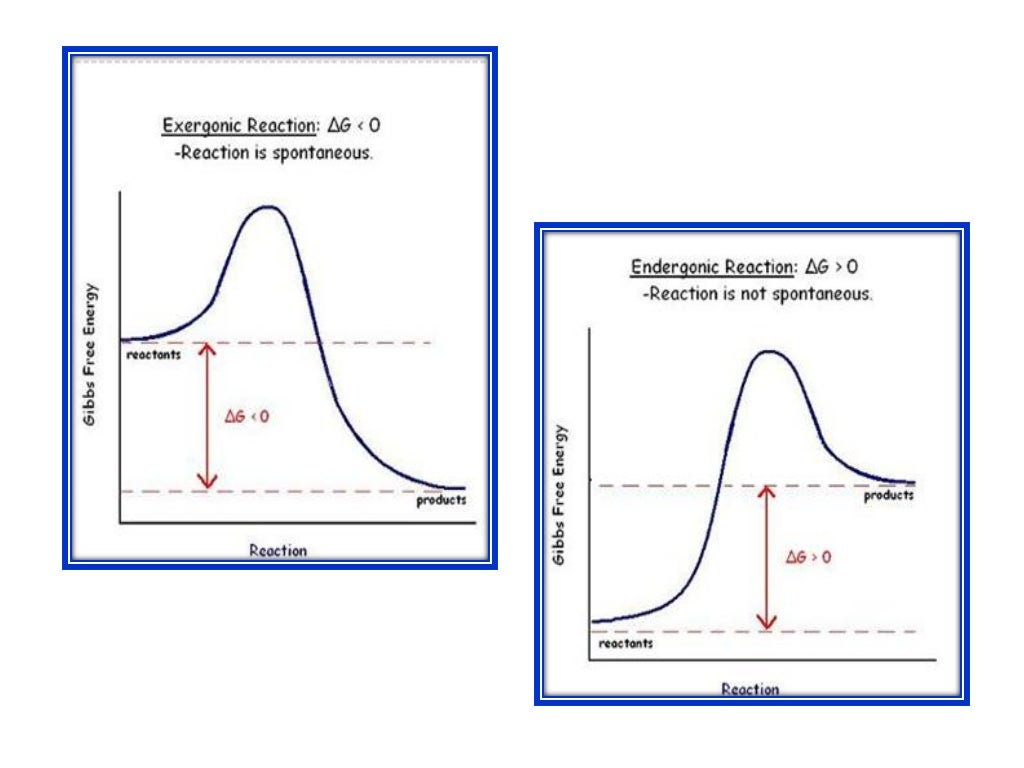
Cambios En La Energía Libre De Gibbs Descritos En Un Diagrama De Reacción De Una Reacción

13 5 La Ley de Hess y la energía libre de Gibbs y el constante de equilibrio YouTube

ENERGÍA LIBRE DE GIBBS Y EQUILIBRIO QuímicaFísica YouTube
Energia libre gibbs
Soluto y solvente definición, cómo diferenciarlos y ejemplos

ENERGÍA LIBRE DE GIBBS, REVERSIBILIDAD Y EQUILIBRIO QUÍMICO/PSU QUÍMICA/CLASE N°26 YouTube

Cambios en la energía libre estándar y la constante de equilibrio YouTube

Energia libre gibbs

Energia Livre De Helmholtz

Lec3.1.1 Energía libre (umh1025 201516) YouTube

Energia libre gibbs

Celdas galvánicas y cambios en la energía libre YouTube

17.8 Energía libre y constante de equilibrio YouTube

Energia Libre De Gibbs Solo Para Adultos En Guatemala

Escala De Entalpia
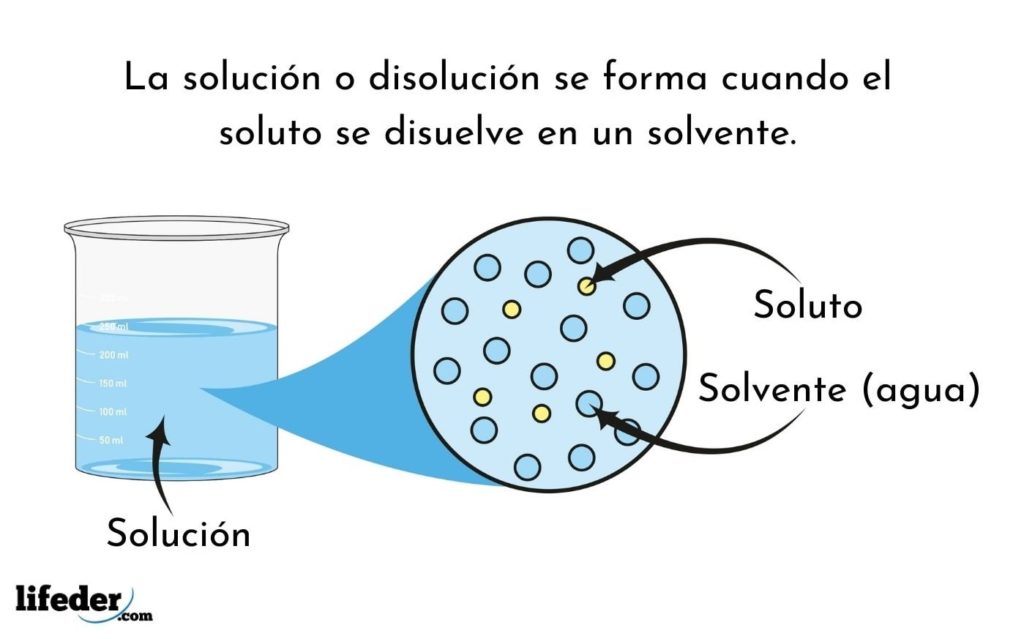
Energía Libre de Mezcla en una Solución de 2 Moléculas de Iguales Dimensiones (Modelo de van Laar) Supongamos una solución ideal de moléculas del tipo A y B, con ambas de idéntica forma y tamaño; y con interacciones energéticas A-A, B-B y A-B todas idénticas entre sí. Esta última condición implica no sólo un mezclado. Los procesos de solvatación sólo estarán termodinámicamente favorecidos si la energía libre de Gibbs de formación de la solución es menor que la suma de la energía libre de Gibbs de formación del solvente y el soluto por separado. La conductividad de una solución depende de la solvatación de sus iones. Aspectos termodinámicos